Aktuality, z kongresov
Monoklonálne protilátky menia situáciu pacientov s migrénou

Prakticky zamerané sympózium organizované spoločnosťou Solen a časopisom Neurologie pro praxi navštívili záujemci z radov neurológov roku 2019 v júni v Brne už po šestnásty raz. Témy odbornej akcie, nad ktorou prevzala záštitu I. neurologická klinika LF MU a FN u sv. Anny a Centrum neurovied LF MU v Brne, boli roztrúsená skleróza, epilepsia, neurodegeneratívne ochorenia a v neposlednom rade samozrejme tiež bolesti hlavy.
Ako neraz zdôrazňovali prednášajúci uvedeného tematického bloku, migréna patrí k častým neurologickým ochoreniam ‒ len v Českej republike žije približne milión postihnutých, z ktorých asi 300 000 má viac ako štyri dni s migrénou za mesiac a približne 50 000 z nich trpí na chronickú migrénu. Táto choroba významne ovplyvňuje kvalitu života pacientov v produktívnom veku a je celosvetovo treťou najčastejšou príčinou invalidizácie a disability u mužov a žien vo veku do päťdesiat rokov. Donedávna nebolo možné časti pacientov účinne pomôcť, táto situácia sa však mení s postupným príchodom monoklonálnych protilátok proti CGRP (calcitonin gene‑related peptide), teda proti kľúčovému neuropeptidu v patofyziológii migrény, alebo proti jeho receptoru.
Migréna na urgentnom oddelení
Doktorka Zuzana Dean z Neurologickej kliniky FN Nitra sa vo svojej prednáške zamerala na problematiku akútnej liečby migrény na urgentnom oddelení. Pripomenula, že v našich krajinách je zvyčajne na oddelenie urgentného príjmu privolaný neurológ, aby urobil diferenciálnu diagnostiku bolestí hlavy a stanovil liečebný postup, zatiaľ čo na západ od našich hraníc robia manažment akútnych atakov bolestí hlavy lekári urgentnej medicíny. Prvým krokom je potvrdenie diagnózy migrény a vylúčenie tehotenstva u žien v reprodukčnom veku, čo je dôležité pre voľbu farmakoterapie. U migrenikov treba tiež počítať s tým, že už nejakú medikáciu užili doma. „Neexistuje štandardný postup pre liečbu akútnej migrény, každý lekár má svoju osvedčenú stratégiu. Dá sa povedať, že na základe klinických štúdií sa ako najúčinnejšie javia neuroleptiká alebo kombinácia ergotamínového prípravku s neuroleptikom. Odporúčajú však zahájiť liečbu parenterálnym podaním nesteroidného antireumatika v kombinácii s metoklopramidom a magnéziom, pretože nemajú nežiaduce účinky, a súčasne ‒ čo je zásadné ‒ venovať pozornosť rehydratácii pacienta. Pokiaľ je dostupný triptán, podáva sa subkutánne,“ uviedla MUDr. Dean a doplnila, že neuroleptiká patria do druhej línie liečby, rovnako ako ergotamíny a opiáty. Podľa prednášajúcej nemajú vo zvládaní akútnych atakov migrény miesto valproát a kortikosteroidy – tie sa môžu viac-menej podať jednorazovo v špecifických prípadoch ako prevencia recidívy.
Nároky na diferenciálnu diagnostiku
Doktor Marek Krivošík z II. neurologickej kliniky LF UK a UN Bratislava nadviazal príspevkom o diferenciálnej diagnostike migrény. „Aby sme mohli migrénu diagnostikovať, je potrebné urobiť diferenciálne diagnostickú úvahu predovšetkým pri prvom záchvate. Rozlišiť primárnu a sekundárnu bolesť hlavy je potrebné aj z toho dôvodu, že primárna bolesť môže často imitovať migrénu,“ zdôraznil MUDr. Krivošík v úvode príspevku a potom sa už venoval jednotlivým krokom diferenciálnej diagnózy. V prvej fáze je dôležitá anamnéza, ktorá by mala zahrnúť popis chronológie bolestí hlavy, rodinnú a liekovú anamnézu. Tu je možné použiť mnemotechnickú pomôcku PQRST, tzv. abecedu bolesti, pomocou nej zisťujeme, čo bolesť vyvoláva, zhoršuje alebo zmierňuje, jej kvantitu a kvalitu, lokalizáciu, silu a intenzitu a dĺžku trvania bolesti. Druhý krok predstavuje objektívny nález, ktorý nás môže nasmerovať na sekundaritu bolestí hlavy – napríklad pri zvýšenej teplote treba vylúčiť infekčnú príčinu či temporálnu arteritídu, pri zvýšenom tlaku krvi PRES syndróm či kardiovaskulárne ochorenie, pri tachykardii ortostatickú hypotenziu a pod. „V diferenciálnej diagnostike nám môže pomôcť aj samotná palpácia v hlavovej oblasti, ktorá nás môže naviesť napríklad na podozrenie na sinusitídu,“ doplnil prednášajúci. V treťom kroku sa lekár sústredí na tzv. red flags, teda varovné príznaky, kde opäť pomáha mnemotechnická pomôcka pod skratkou SNOOP: S = systémové príznaky a ochorenie; N = neurologické príznaky; O = výskyt novej bolesti alebo zmena charakteru bolesti, výskyt bolesti po 50. roku života, výskyt tzv. thunderclap bolesti hlavy; P = papiloedém, pulzačný tinitus, provokácia bolesti pozíciou alebo cvičením. Vo štvrtom kroku prichádzajú na rad zobrazovacie a pomocné vyšetrenia, ktoré zahrňujú CT mozgu, likvorologické vyšetrenie, MR mozgu (preferované pred CT), MR chrbtice a tváre, ultrasonografiu nervus opticus, fundoskopiu a laboratórne vyšetrenia.
„Piatym krokom je potom vylúčenie primárnej bolesti hlavy, lebo migréna je zákerná v tom, že môže mať rôzne podoby – môže byť bilaterálna alebo sa mení, môže byť mierna a nemusí byť pulzujúca, môže byť kontinuálna, trvať menej ako štyri hodiny alebo viac ako 72 hodín, nemusia sa pri nej vyskytovať pridružené symptómy, môže sa objaviť aura bez bolestí hlavy či interiktálna hypersenzitivita,“ vysvetlil doktor Krivošík. V prípade primárnych bolestí hlavy môže byť migréna zamieňná za tenzný typ bolestí hlavy, hemicrania continua, cluster headache alebo tiež za novú dennú perzistujúcu bolesť hlavy. Tenzná bolesť býva nezriedka kombinovaná (napr. tenzná a migrenózna bolesť hlavy), problematické je aj jej odlíšenie od migrény bez aury. U hemicrania continua dochádza často k poddiagnostikovaniu, v diferenciálnej diagnóze teda môže pomôcť poznatok, že sa najčastejšie vyskytuje okolo tretej dekády veku s prevahou u žien, je vždy unilaterálne, kraniálne autonómne príznaky sú prítomné vo viac ako 75 % prípadov (u migrenikov približne v 56 %) a je sprevádzaná autonómnymi príznakmi ako fotofóbia, fonofóbia, nauzea alebo zvracanie. Cluster headache môže byť s migrénou zamieňaná predovšetkým pri dlhšom trvaní a pri kombinácii niekoľkých typov bolesti. Nová denná perzistujúca bolesť hlavy (new daily persistent headache, NDPH) sa prejavuje dennými bolesťami hlavy, ktoré vznikajú náhle a môžu mať rysy migrény, tenzných bolestí hlavy alebo oboch typov. Približne 20 % takto postihnutých pacientov má predchádzajúcu históriu migrény a choroba je často diagnostikovaná ako chronická migréna.
Príčinou sekundárnych bolestí hlavy, ktoré môžu imitovať migrénu, sú najmä cerebrovaskulárne alebo vaskulárne postihnutie (napr. arteriálna hypertenzia), nádory, tzv. SMART syndróm (stroke like migraine attacks after radiation therapy), infekcia, intrakraniálna hypotenzia/hypertenzia, epilepsia, glaukóm alebo Alice in Wonderland syndróm (AIWS). Bolesťou hlavy podobnou migréne sa môžu manifestovať arteriovenózne malformácie (so zrakovou aurou sú popisované u arteriovenóznych malformácií v okcipitálnom laloku), ich charakteristika však spravidla nespĺňa kritériá migrény, bolesť hlavy sa vo viac ako 95 % vyskytuje na jednej strane a u pacientov je zaznamenávaná dobrá odpoveď na liečbu analgetikami. Reverzibilný cerebrálny vazokonstrikčný syndróm je spojený s tzv. thunderclap bolesťou hlavy s nauzeou/vomitom a fotofóbiou, ktorá vzniká spontánne alebo po kašli, cvičení a podobne. Ide o prechodnú mozgovú vazokonstrikciu, ktorá sa zvyčajne sama upraví po 1‒3 mesiacoch.
K sekundárnym bolestiam patrí ďalej bolesť hlavy, spojená s neurologickým deficitom a cerebrospinálnou fluidnou lymfocytózou. Býva väčšinou strednej až silnej intenzity, s výskytom unilaterálne alebo bilaterálne, trvá spravidla niekoľko hodín, je často spojená s nauzeou a zvracaním, nasleduje prevažne po prechodnom neurologickom deficite (hemiparéza, afázia a pod.) a nezriedka recidivuje. V rámci diferenciálnej diagnózy migrény je ďalej potrebné vylúčiť tzv. bolesť z nadužívania liekov (medication overuse headache, MOH), ktorá sa vyskytuje výlučne u pacientov (s prevahou žien) s preexistujúcou chronickou bolesťou hlavy. Choroba spočíva v akútnej eskalácii bolestí hlavy po odňatí liečby, bolesť sa objavuje denne, najčastejšie v ranných hodinách pri prebudení, a nemá žiadny špecifický príznak.
Iktálna epileptická bolesť hlavy je zriedkavým ochorením, kedy migréna alebo tenzný typ bolesti hlavy predstavuje jedinú manifestáciu záchvatu. Od migrény sa epilepsia dá odlíšiť aj na základe charakteristiky zrakových halucinácií ‒ epileptické začínajú v prvý sekundách záchvatu, trvajú niekoľko minút a sú spravidla farebné a cirkulárne, migrenózne zrakové aury sa rozvíjajú niekoľko minút, trvajú 5‒60 minút a sú spravidla čiernobiele a lineárne.
Alice in Wonderland syndróm sa prejavuje ako zriedkavá forma migrenóznej aury, ktorá je popisovaná ako paroxysmálna skúsenosť s iluzívnym obrazom vlastného tela, častejšie sa vyskytuje u detí.
Diagnóza migrény teda predstavuje veľmi náročný proces, dá sa stanoviť len pri opakovaní záchvatu a je založená na klinických kritériách. Často môže dôjsť k prekrývaniu niekoľkých typov bolestí hlavy, z tohto dôvodu je v Medzinárodnej klasifikácii bolestí hlavy (International Classification of Headache Disorders, ICHD‑3) používaný termín „pravdepodobná migréna“, „pravdepodobná tenzná bolesť hlavy“. „Pokiaľ pacient spĺňa kritéria pre viac ako jeden typ, podtyp alebo podformu migrény, mali by byť diagnostikované všetky. Ak sa preexistujúca migréna u pacienta zhorší, je opäť nutné vylúčiť sekundaritu,“ zhrnul doktor Krivošík.
Charakteristika monoklonálnych protilátok
Prehľadu anti‑CGRP monoklonálnych protilátok venoval svoju prezentáciu MUDr. David Doležil, Ph.D., MBA, z Headache centrum Praha, DADO MEDICAL, s.r.o., a Mestskej polikliniky Praha. Prednášajúci najprv pripomenul patofyziológiu migrény, kedy sa v trigeminovaskulárnom systéme začnú uvoľňovať substancie P alebo neurokinín A, a najmä CGRP, čo následne umožní uvoľnenie zápalových cytokínov a ostatných látok. Pri mechanizme, ktorý vedie ku vzniku sterilného zápalu, pacient vníma všetky príznaky bolesti. Znalosť týchto patofyziologických mechanizmov lekárovi zároveň umožňuje zasahovať liečebne. Jediný akútny špecifický liek pre migrénu predstavujú triptány, pre profylaxiu máme v súčasnosti k dispozícii práve monoklonálne protilátky, ktoré môžu zasahovať cielene do patofyziológie migrény. K anti‑CGRP protilátkam sa zaraďuje eptinezumab, ktorý čaká na schválenie americkým Úradom pre kontrolu potravín a liečiv (Food and Drug Administration, FDA), erenumab, fremanezumab a galkanezumab sú už registrované Európskou liekovou agentúrou (European Medicines Agency, EMA). Uvedené štyri molekuly sa líšia svojím typom, podtriedou imunoglobulínov, miestom pôsobenia, biologickou dostupnosťou, biologickým polčasom, spôsobom podania a dávkou (tab. 1). „Monoklonálne protilátky vznikali z potreby nájsť špecifickú profylaktickú liečbu. Tomu napomohli malé molekuly (gepanty), ktoré boli skúšané ako antagonisti CGRP, pri vývoji sa však u celého radu z nich objavila veľká hepatotoxicita, a väčšina teda bola z tohto dôvodu z klinických štúdií vyňatá. Aktuálne sa testujú dve malé molekuly, ktoré by mohli byť používané v akútnej liečbe migrény,“ doplnil doktor Doležil.
| TAB. 1 Anti-CGRP protilátky a ich základné vlastnosti | ||||
|---|---|---|---|---|
|
|
eptinezumab |
erenumab |
fremanezumab |
galkanezumab |
|
typ protilátky |
humanizovaná |
humánna |
humanizovaná |
humanizovaná |
|
miesto pôsobenia |
priama väzba na CGRP |
väzba na receptor pre CGRP |
priama väzba na CGRP |
priama väzba na CGRP |
|
podtrieda IgG |
1 |
2 |
2a |
4 |
|
biologická dostupnosť (%) |
100 |
40-74 |
? |
40 |
|
biologický polčas (dni) |
28 |
21 |
45 |
25-30 |
|
podanie |
i.v. kvartálne |
s.c. mesačne |
s.c. mesačne/kvartálne |
s.c. mesačne |
|
dávky |
100,300 mg |
70,140 mg |
225,675 mg* |
120,240 mg |
Všetky štyri molekuly boli skúšané v liečbe epizodickej aj chronickej migrény najprv v klinických štúdiách fázy II. Účinnosť a bezpečnosť monoklonálnych protilátok bola definitívne potvrdená klinickými hodnoteniami fázy III, a na ich základe došlo tiež ku schváleniu FDA a EMA. Prednášajúci ďalej zdôraznil, že dôležitým faktorom novej terapie anti‑CGRP monoklonálnymi protilátkami je skutočnosť, že táto liečba preukazuje efekt u pacientov, u ktorých už predtým zlyhali iné profylaktické terapie. Monoklonálne protilátky rovnako žiadnym spôsobom neovplyvňujú imunitný systém.
Erenumab (plne humánna protilátka IgG2, namierená proti receptoru pre CGRP) bol spočiatku testovaný v dávkach 7 mg, 21 mg a 70 mg, menšie dávky neboli účinné, preto sa následne testovalo 70 mg a 140 mg. Vo všetkých štúdiách bol primárnym cieľovým ukazovateľom, a teda základným kritériom pre posúdenie účinnosti liečby počet dní s migrénou v mesiaci (monthly migraine days, MMD) a redukcia tohto počtu k určitému dátumu, prípadne podiel pacientov, ktorí majú viac ako 50 % MMD. V rámci sledovania bezpečnosti sa nepozorovali žiadne závažné nežiaduce účinky ani laboratórne a EKG abnormality. Tieto predbežné výsledky boli potvrdené v ďalších štúdiách fázy III. Štúdia ARISE, do ktorej bolo zaradených celkom 577 dospelých, porovnávala erenumab podávaný v dávke 70 mg oproti placebu po dobu troch mesiacov. Signifikantná redukcia MMD bola potvrdená u skupiny s erenumabom počas 9.‒12. týždňa. Medzi najčastejšie nežiaduce účinky patrila obstipácia (u 2 % pacientov). Do štúdie fázy III STRIVE bolo zaradených 955 pacientov (placebo vs. erenumab 70 mg a 140 mg). Signifikantná redukcia MMD sa dosiahla u oboch dávok erenumabu, s lepšími výsledkami pri dávke 140 mg. Efektivita a bezpečnosť erenumabu u pacientov s chronickou migrénou bola najprv hodnotená v multicentrickej, placebom kontrolovanej, randomizovanej štúdii fázy II. Bolo do nej zaradených celkovo 667 subjektov vo veku 18‒65 rokov do ramien so 70 mg a so 140 mg erenumabu a s placebom. Štúdia trvala 12 týždňov a erenumab bol aplikovaný raz mesačne subkutánne. Signifikantná redukcia MMD oproti placebu bola preukázaná v oboch skupinách s erenumabom, o niečo lepšie parametre boli doložené pre dávku 140 mg.
Fremanezumab (plne humanizovaná protilátka IgG2a s väzbou na CGRP) bol hodnotený v štúdii fázy III HALO, na základe výsledkov štúdií fázy II podobne ako u ostatných anti‑CGRP monoklonálnych protilátok, u pacientov s chronickou migrénou. Bolo randomizovaných celkovo 1 130 dospelých. Pacienti boli rozdelení do troch ramien v pomere 1 : 1 : 1 so subkutánnym podaním študijnej látky raz mesačne. V prvom ramene bol ako prvá dávka podávaný fremanezumab 675 mg, ako druhá a tretia dávka placebo. V druhom ramene pacienti dostávali 675 mg fremanezumabu v prvej dávke, 225 mg v druhej a tretej dávke každé štyri týždne; tretie rameno bolo s placebom. Obe aktívne skupiny vykázali štatisticky významné zlepšenie vo všetkých sledovaných parametroch. Podiel pacientov s minimálne 50% redukciou MMD bol v ramene s dávkou 675 mg kvartálne 38 %, v ramene s mesačnou dávkou fremanezumabu 41 % a len 18 % v placebovej skupine. Podiel nežiaducich účinkov bol v placebovej skupine 64 %, 70 % v ramene s kvartálnym podaním, 71 % v ramene s mesačným podaním fremanezumabu, väčšinou išlo o mierne nežiaduce účinky. V štúdii HALO EM v indikácii prevencie epizodickej migrény bolo zaradených 875 pacientov do troch ramien v pomere 1 : 1 : 1. V prvom ramene užívali 225 mg fremanezumabu subkutánne raz mesačne, v druhom ramene 675 mg v prvej dávke, druhý a tretí mesiac placebo, v treťom ramene placebo. Redukcia hodnoty MMD predstavovala pokles z 8,9 na 4,6 dňa v ramene s mesačným podaním, z 9,2 na 4,9 dne vo vetve s kvartálnym podaním, z 9,1 na 5,9 dňa u placeba. Podiel pacientov s viac ako 50% redukciou MMD počas 12týždňového liečebného obdobia bol 47,7 % v ramene s mesačným podaním fremanezumabu, 44,4 % u vysokodávkovaného kvartálního fremanezumabu. Výskyt nežiaducich účinkov bol 48 %, resp. 47 %, resp. 37 % u placeba.
Galkazenumab (plne humanizovaná protilátka IgG4 cielená na CGRP ligand) bol hodnotený v štúdii fázy III EVOLVE‑1, kam bolo randomizovane zaradených 1 671 dospelých s epizodickou migrénou do troch ramien v pomere 2 : 1 : 1 s mesačnom subkutánnym podávaním študijnej látky v dávke 120 mg, 240 mg a s placebom. Predchádzajúca preventívna terapia migrény predstavovala vylučujúce kritérium pre zaradenie. Obe ramená s aktívnou látkou preukázali signifikantné zlepšenie, redukciu MMD počas šiestich mesiacov trvania štúdie – 4,6 dňa, 4,7 dňa, 2,8 dňa v porovnaní s placebovou vetvou. U významne vyššieho počtu pacientov v oboch ramenách s galkanezumabom bola zaznamenaná 50%, 75% a 100% redukcia MMD v porovnaní s placebom. Podobné výsledky sa dosiahli aj v štúdii EVOLVE‑2. Do dvojito zaslepenej, randomizovanej, placebom kontrolovanej štúdie fázy III REGAIN u pacientov s chronickou migrénou bolo randomizovaných 1 113 dospelých do troch ramien v pomere 2 : 1 : 1 s mesačne subkutánne podávaným galkanezumabom v dávke 120 mg, 240 mg a s placebom. Východisková hodnota MMD bola rovnaká naprieč všetkými skupinami (19,4 dňa). Obe ramená s galkanezumabom vykázali počas trojmesačného liečebného obdobia signifikantné zlepšenie. U priemerného podielu pacientov s viac ako 50% redukciou MMD bolo rovnako preukázané významné zlepšenie v aktívnych ramenách.
Eptinezumab (humanizovaná protilátka IgG1, ktorá sa selektívne viaže k obom izoformám CGRP – α‑CGRP a β‑CGRP) bol testovaný v štúdii fázy III PROMIS 1 s 888 dospelými, ktorí boli zaradení do ramena s placebom a do ramien s 30 mg, 100 mg a 300 mg eptinezumabu, podávanými intravenózne každých 12 týždňov. Hodnota MMD bola pred zahájením terapie 8,5 dňa. Výskyt nežiaducich účinkov nebol signifikantne rozdielny medzi skupinou placeba a podávaním eptinezumabu vo všetkých skupinách. Po dvoch infúziách eptinezumabu 300 mg podávaných po 12 týždňov sa podiel pacientov s viac ako 50% redukciou MMD zvýšil z 56,3 % v týždňoch 1‒4 na 63,1 % v týždňoch 21‒24 a s viac ako 75% redukciou z 31,3 % na 40,5 % (300 mg) v porovnaní s placebom (z 20,3 na 32,4 %). V prípade 100% redukcie to bolo zo 14,9 na 23,4 %, respektíve z 5,9 na 14,4 %. V štúdii PROMISE 2 bolo randomizovaných 1 072 pacientov do ramien s 300 mg alebo so 100 mg eptinezumabu alebo s placebom. Eptinezumab bol podávaný intravenózne raz za 12 týždňov. Primárnym cieľovým ukazovateľom bola priemerná zmena MMD pred liečbou a v 12. týždni terapie. Pacienti v oboch aktívnych ramenách dosiahli signifikantné zlepšenie oproti placebu.
Nová terapia anti‑CGRP monoklonálnymi protilátkami sa stane zrejme najväčším prínosom pre pacientov, u ktorých zlyhala jedna alebo viac profylaktických liečebných metód, a takých pacientov je u nás pravdepodobne takmer 16 000, uzavrel doktor Doležil svoj príspevok.
Ako liečiť migrénu v gravidite a pri laktácii, migréna a hormonálna antikoncepcia
Tejto dôležitej téme, ktorá obsahuje celý rad špecifík, ktoré by mal poznať nielen neurológ, ale aj praktický lekár, internista alebo gynekológ, sa venovala MUDr. Ingrid Niedermayerová z II. neurologickej kliniky LF MU a FN Brno.
Ženské pohlavné hormóny majú na centrálny nervový systém efekt stimulačný ‒ estrogény sú prokonvulzívne, modulujú bolesť, provokujú migrenóznu auru ‒ a inhibičný ‒ progesteron a jeho metabolity stabilizujú náladu, pôsobia anxiolyticky, anesteticky, antiepilepticky. V gravidite dochádza k enormnému nárastu koncentrácie estrogénov a k ďalším metabolickým zmenám, napr. ku zvýšeniu hodnôt endorfínov. „V prípade migrény je podstatné, či pacientky trpeli pred graviditou na migrénu s aurou, alebo migrénu bez aury. U žien bez aury je druhý a tretí trimester obdobím s výraznou redukciou výskytu migrenóznych záchvatov alebo celkom bez nich. U žien s aurou často dochádza v priebehu gravidity k nárastu počtu záchvatov, niekedy mávajú izolované aury,“ vysvetlila doktorka Niedermayerová. Občas prichádza pacientka s novovzniknutou migrénou s aurou, aj keď na ňu nikdy predtým netrpela – v tomto prípade je potrebné vylúčiť iné závažné cerebrálne diagnózy (cerebrálnu venóznu trombózu, cievnu mozgovú príhodu, apoplexiu hypofýzy, ale tiež preeklampsiu). Migréna ako taká nepredstavuje riziko pre plod.
Prednášajúca ďalej naznačila liečebné možnosti, ktoré sú gravidným pacientkam ponúkané v bežnej klinickej praxi (akútne medikácie podľa SPC platných k 31. 12. 2018 v ČR). K dispozícii sú tri základné skupiny liekov, a to 1) lieky celkom bezpečné; 2) lieky, kedy je nutné posúdiť výhodu podania a riziko pre pacientku; 3) lieky neodporúčané alebo kontraindikované. Bezpečným liekom zostáva stále paracetamol, prípadne jeho kombinácia s kofeínom. V skupine nesteroidných antiflogistík (NSA) došlo k určitým zmenám – bežné NSA je možné podať v prvom a druhom trimestri (kyselina acetylsalicylová – ASA, ibuprofen, diklofenak, naproxen, nimesulid, ketoprofen), v treťom trimestri sú však kontraindikované. V pôvodných odporúčaniach bol podľa upozornenia doktorky Niedermayerovej uvádzaný len druhý trimester s podaním ibuprofenu. Sumatriptan sa môže užiť v prvom trimestri, druhý a tretí trimester vyžaduje prísne posúdenie, ostatné triptány a ergotamín sú kontraindikované. Metamizol sa môže podať v druhom trimestri. Z antiemetík je povolený metoklopramid v prvom a druhom trimestri, naopak tietylperazin sa v gravidite vôbec neodporúča. Pokiaľ ide o opioidy (skôr v prípade ambulantných pacientov), tramadol, príp. oxykodon ako zástupci silných opioidov nie sú odporúčané, za určitých okolností je možné podať kodeín, avšak až od piateho mesiaca tehotenstva. V profylaxii je celkom bezpečné magnézium, s posúdením rizík sa môže podať metoprolol, avšak s tým, že po pôrode môže dôjsť k bradykardii novorodencov. Ďalej sa môžu užívať aj niektoré antidepresíva (venlafaxin, citalopram, popř. cinarizin), celkom kontraindikovaný je z dôvodov teratogénnych účinkov valproát a topiramát, pre gabapentin nie je dostatok údajov.
V období laktácie dochádza u pacientiek spravidla k návratu migrény, ktorý však závisí aj od toho, či dojčiaca žena má, či nemá ovulační cyklus. Pokiaľ žena nedojčí, približne po mesiaci sa v 50 % prípadov vracajú prvé záchvaty. Bezpečným liekom v období laktácie (opäť podľa SPC platných k 31. 12. 2018 v ČR) je zo skupiny NSA okrem paracetamolu tiež ibuprofen, ktorý je považovaný za liek prvej voľby. S posúdením rizika a výhody sa z NSA môže použiť len ASA, ostatné sa neodporúčajú. Pokiaľ volíme triptány, treba ženu upozorniť, že musí prerušiť dojčenie (u sumatriptánu na 12 hodín, u eletriptánu na 24 hodín). Ak sa aplikuje metamizol, prerušuje sa dojčenie na 48 hodín, v prípade podania jednotlivej dávky tramadolu sa dojčenie neprerušuje. V rámci profylaktickej liečby môžeme podať magnézium, avšak nie je príliš účinné, je teda možné siahnuť do skupiny antidepresív – venlafaxin, amitriptylin, sertralin, citalopram, prípadne gabapentin. Neodporúčajú sa podobne ako v tehotenstve valproát, topiramát, cinarizin, kontraindikované sú betablokátory.
Ďalšou významnou oblasťou, na ktorú sa prednášajúca zamerala a ktorou sa tiež dá ovplyvniť migréna, je hormonálna antikoncepcia, ktorá pri správnom cielení môže dokonca zmierniť výskyt ochorenia. Hormonálna antikoncepcia môže byť kombinovaná – so zložkou estrogénnou (nízka dávka etinylestradiolu 35 μg po ultranízku dávku 15 μg) a progestínovou. Lekár by mal vedieť, že existujú rôzne režimy podania – jednofázové, viacfázové (troj‑, päťfázové), režim 21 + 7 (s tzv. placebo fázou), skrátené režimy 24 + 4, 26 + 2, predĺžený režim 84 + 7 (s placebo fázou alebo s veľmi nízkou dávkou etinylestradiolu). Progestínová antikoncepcia je k dispozícii vo forme perorálnej, parenterálnej či vnútromaternicového telieska.
Postup pre voľbu antikoncepcie u žien trpiacich na migrénu je ošetrený odporúčaniami Svetovej zdravotníckej organizácie (WHO), v roku 2018 bol publikovaný konsenzus Európskej federácie bolestí hlavy (EHF) a Európskej spoločnosti pre antikoncepciu a reprodukčné zdravie (ESCRH) a vychádza sa aj z odporúčaní Českej gynekologicko‑pôrodníckej spoločnosti ČLS JEP. Výsledky populačných štúdií ukazujú, že ženy bez anamnézy migrény pri užívaní kombinovanej perorálnej antikoncepcie (COC) nemajú vyššie riziko rozvoja migrény v porovnaní s kontrolami. Preexistujúca migréna pri užívaní COC zostáva bez zmien v 44‒67 % prípadov, zhoršenie nastáva v 24‒35 % a zlepšenie v 5‒8 %, migréna sa objavuje v menštruačnej pauze z dôvodu prerušenia užívania estrogénov.
U migrény bez aury sú odporúčané prípravky monofázické, pretože nemenia koncentrácie estrogénu. „Niekedy gynekológovia odporúčajú ultranízkodávkované prípravky, tie však nedostatočne tlmia hypotalamo‑hypofýzo‑gonadálnu os a môže dôjsť k vyššej frekvencii rozvoja záchvatov,“ zdôraznila MUDr. Niedermayerová. U žien s menštruačnou migrénou môžeme voliť dve stratégie – buď udržovať stabilne vyššiu koncentráciu estrogénu (kombinovaná antikoncepcia v rozšírenom cykle), alebo naopak stabilne nízku koncentráciu estrogénu (čisto progestínová antikoncepcia). U žien v preklimaktériu podávame progestínovú perorálnu alebo parenterálnu antikoncepciu. Najrizikovejšiu skupinu tvoria pacientky s migrénou a aurou, u ktorých pri užívaní COC nastáva až v 60 % zhoršenie záchvatov (podľa údajov z USA). Môže u nich dôjsť k novému výskytu aury, k rozvoju migrenózneho infarktu, zvlášť pokiaľ má žena ďalšie rizikové cievne faktory. Preto je u týchto pacientiek COC kontraindikovaná a je možné im podať len samotnú gestagénnu antikoncepciu.
Absolútnou kontraindikáciou užívania COC sú podľa odporúčaní WHO migréna s aurou, migréna bez aury, ktorá vznikne pri užívaní COC u žien vo veku nad 35 rokov a u fajčiarok a prekonaná cievna mozgová príhoda. Relatívnu kontraindikáciu užívania COC predstavujú migréna bez aury u žien starších ako 35 rokov a migréna bez aury, ktorá vznikne pri užívaní COC u žien mladších ako 35 rokov. Relatívnou kontraindikáciou samotnej progestínovej hormonálnej antikoncepcie je migréna s aurou, ktorá vznikne pri užívaní tohto typu antikoncepcie. „Uvedené kritériá sú veľmi prísne a užívanie antikoncepcie treba riešiť individuálne, absolútne kontraindikácie však platia bezpodmienečne a môžeme ich brať ako kľúčové poučenie pre gynekológov,“ uzavrela doktorka Niedermayerová.
Migréna v praxi, skúsenosti s fremanezumabom
Na najčastejšie otázky z radov lekárov, ktorí sa migrénou nezaoberajú celkom bežne, aj z radov pacientov sa pokúsila odpovedať primárka MUDr. Jolana Marková, FEAN, z Neurologickej kliniky 3. LF UK a Thomayerovej nemocnice v Prahe.
Jedna z najčastejších otázok znie, či postačuje, keď diagnózu migrény stanoví praktický lekár. „Pokiaľ ide o migrénu bez aury, spĺňa diagnostické kritériá a vyzerá typicky, záchvaty nie sú časté a je zaznamenaný spoľahlivý efekt triptánov, nie je dôvod, aby pacient vyhľadával ďalšiu pomoc. Ak ide o komplikovanejší priebeh, v každom prípade u migrény s aurou, mal by pacient navštíviť neurológa. Pokiaľ migrenózny proces začína, treba vylúčiť sekundaritu,“ uviedla primárka Marková a doplnila, že neurológ by mal zasiahnuť aj u pacientov, u ktorých sa objavujú časté ataky migrény, alebo u ktorých nedostatočne účinkujú triptány a špecifické antimigreniká, alebo v prípade, že pacient tieto lieky netoleruje a nahrádza ich inými, čo často vedie k nadužívaniu medikácie. Na akútne ambulancie nemocníc sa väčšinou dostavujú pacienti s prvým atakom migrény, s prolongovaným atakom alebo s prolongovanou aurou, rovnako tiež pacienti s prvým atakom hemiplegickej migrény. U týchto pacientov prednášajúca v nadväznosti na prvý príspevok znovu zdôraznila nutnosť rehydratácie, pretože pokiaľ taký pacient dostane liek, a nie sú doplnené tekutiny, nie je možné dosiahnuť dobrý efekt.
Pri druhej otázke, či je potrebné robiť u každého pacienta s migrénou zobrazenie (a či lepšie CT, alebo MR), sa primárka Marková obrátila najprv k americkým odporúčaniam. Subkomisia pre štandardy Americkej neurologickej akadémie (AAN) nepovažuje zobrazenie za povinné u pacientov s migrénou, ktorá spĺňa kritériá Medzinárodnej organizácie pre diagnostiku a liečbu bolestí hlavy (IHS) a u ktorej je normálny neurologický nález. Rovnako Americká spoločnosť pre bolesti hlavy (AHS) odporúča nerobiť zobrazenie u pacientov so stabilnými nemennými bolesťami hlavy, ktoré spĺňajú kritériá pre migrénu. „Zobrazenie nie je potrebné u každého pacienta, ale vždy ich odporúčame napríklad u nového pacienta s migrénou s aurou, u anxiózneho pacienta alebo pri výskyte aneuryzmy v rodinnej anamnéze pre uspokojenie pacienta a podobne,“ uviedla na základe praktických skúseností prednášajúca.
Lekári sa tiež pýtajú, načo sú centrá pre diagnostiku a liečbu bolestí hlavy a načo by mali slúžiť plánované centrá pre liečbu migrény. „Tieto centrá sú určené pre pacientov, u ktorých sa liečba nedarí. Overujeme v nich diagnózu, overujeme, prečo medikácia nepomáha, či bola podávaná v dostatočnej dávke a po dostatočne dlhé obdobie, či pacient dodržiava určité režimové opatrenia. Najdôležitejšie je vždy odporúčanie individualizovaného postupu ‚na mieru‘ pre každého jednotlivého pacienta,“ vysvetlila primárka Marková.
V tejto súvislosti tiež nie je možné jednoznačne odpovedať na otázku, čo sa má odporúčať všeobecne len na profylaxiu migrény. Opäť tu platí, že rozhodovať môžeme len u konkrétneho pacienta, o ktorom poznáme ďalšie podrobnosti. Toto stanovisko podporila prednášajúca príkladom odporúčania najlepšieho postupu v prípade dvoch odlišných pacientiek, ktoré obe trpia na migrénu bez aury s atakami 2‒3× za týždeň.
V druhej časti prednášky sa primárka Marková venovala fremanezumabu a klinickej štúdii HALO, ktorá preukázala účinnosť a bezpečnosť tejto anti‑CGRP monoklonálnej protilátky u pacientov s epizodickou i chronickou migrénou, a doplnila tiež vlastné skúsenosti s liečbou z domovského pracoviska, ktoré sa na štúdii zúčastnilo.
Fremanezumab, ktorý aktuálne čaká na úhradu, bol hodnotený v dvoch štúdiách tretej fázy HALO, ktoré preukázali, že tak pacienti s chronickou, ako aj pacienti s epizodickou migrénou dosiahli počas dvanásťtýždennej liečby štatisticky významné zlepšenie vo všetkých primárnych aj sekundárnych cieľových ukazovateľoch (podrobné údaje k štúdii už vo svojom príspevku uviedol MUDr. Doležil). Zistilo sa tiež, že pacienti, liečení fremanezumabom užívali signifikantne menej akútnej medikácie v porovnaní s pacientmi v ramene s placebom. „Naše pracovisko sa zúčastnilo aj v pokračovaní štúdie HALO, kedy kontrolná návšteva u celkovo 12 žien a jedného muža prebehla za 7,5 mesiaca po poslednej dávke lieku. Títo pacienti trpeli na častú epizodickú migrénu alebo chronickú migrénu. Všetci pacienti mali záujem pokračovať v otvorenej fáze štúdie a všetci tiež hodnotenie dokončili. Niektorí pacienti, u ktorých došlo počas aktívnej liečby k významnému zlepšeniu, zostali po ôsmich mesiacoch bez terapie na rovnakom počte dní s migrénou ako pred zahájením liečby. Na druhej strane evidujeme aj takých, ktorí si zlepšenie udržali a ich pôvodne veľmi nepriaznivý stav sa dokázal po určitom čase liečby stabilizovať,“ okomentovala výsledky malej vzorky pacientov z Thomayerovej nemocnice primárka Marková (tab. 2).
| TAB 2 Follow-up štúdia HALO – výsledky skupiny pacientov z Thomayerovej nemocnice v Prahe | ||||||
|---|---|---|---|---|---|---|
|
pacient |
vek |
žena/muž |
CM/EM |
Frekvencia atakov na začiatku |
Frekvencia atakov na konci |
Frekvencia atakov po 8 mesiacoch |
|
1 |
47 |
ž |
fEM |
9 |
3 |
6 |
|
2 |
45 |
ž |
CM |
17 |
5 |
10 |
|
3 |
44 |
ž |
fEM |
11 |
2 |
9 |
|
4 |
52 |
ž |
fEM |
9 |
4 |
9 |
|
5 |
51 |
ž |
fEM |
8 |
1 |
2 |
|
6 |
53 |
ž |
fEM |
7 |
1 |
1 |
|
7 |
58 |
ž |
fEM |
10 |
5 |
12 |
|
8 |
54 |
m |
fEM |
9 |
2 |
3 |
|
9 |
60 |
ž |
fEM |
11 |
2 |
4 |
|
10 |
47 |
ž |
fEM |
8 |
3 |
3 |
|
11 |
45 |
ž |
fEM |
10 |
5 |
10 |
|
12 |
60 |
ž |
CM |
18 |
3 |
12 |
Ďalšou klinickou štúdiou s terapiou fremanezumabom bola FOCUS (TV48125‑CNS‑30068), multicentrické, randomizované, dvojito zaslepené a placebom kontrolované hodnotenie s otvorenou fázou, ktoré sledovalo účinnosť a bezpečnosť tejto anti‑CGRP protilátky v profylaktickej liečbe u viac ako 800 pacientov trpiacich na chronickú alebo epizodickú migrénu, u ktorých bola zaznamenaná nedostatočná odpoveď na 2‒4 predchádzajúce preventívne terapie. Štúdia bola členená na 12týždenné dvojito zaslepené, placebom kontrolované obdobie a na 12týždennú otvorenú fázu s nasledujúcou bezpečnostnou kontrolou uskutočnenou za šesť mesiacov po poslednej dávke lieku. Hodnotenie preukázalo, že pacienti liečení fremanezumabom dosiahli štatisticky významné zníženie MMD v porovnaní s placebom (primárny cieľový ukazovateľ), a to o 4,1 dňa pri mesačnej liečbe (vs. 0,6 dňa v placebovom ramene) a o 3,7 dňa pri kvartálnej liečbe (p < 0,0001), graf 1A, B. „Na výsledkoch štúdie FOCUS ma zaujalo, že placebo u skutočne rezistentných pacientov nefunguje, nedosahuje taký efekt ako v štúdii HALO. Fremanezumab mal oproti tomu u týchto pacientov signifikantný účinok a opäť boli porovnateľné výsledky oboch režimov podávania, teda mesačného a kvartálneho, podobne ako v štúdiách HALO. Naše pracovisko sledovalo v rámci štúdie FOCUS 11 pacientov, k významnému zlepšeniu došlo u siedmich z nich, avšak u piatich podstatne zlepšených pacientov nastala po polroku bez liečby recidíva ťažkostí,“ doplnila primárka Marková a dodala, že fremanezumab je veľmi dobre tolerovaný, bez výskytu závažných nežiaducich účinkov a s minimom bežných nežiaducich reakcií.
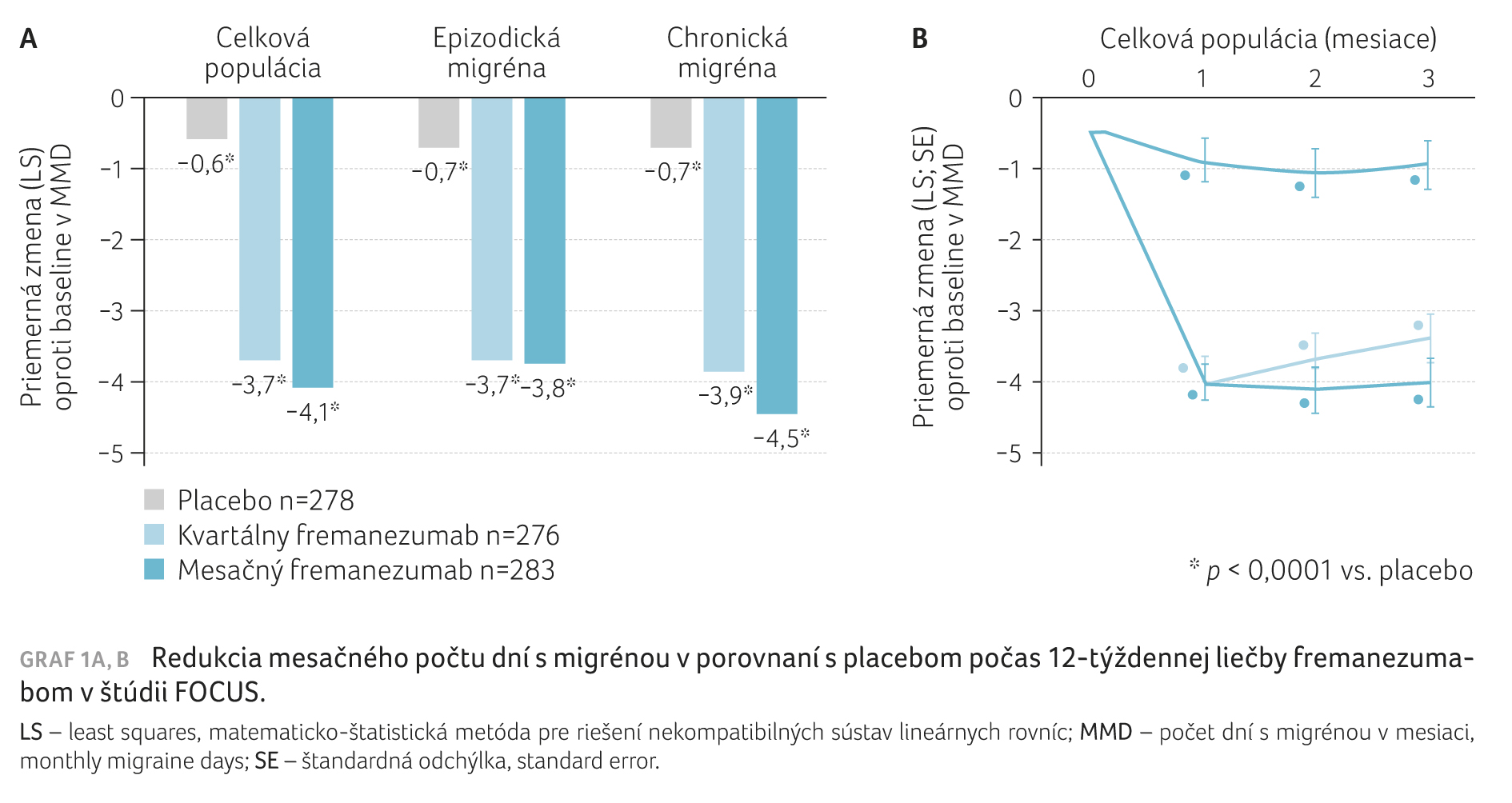
Výsledky zo sledovania v Thomayerovej nemocnici i výsledky celej štúdie predstavujú určitý podklad pre odhad, ako dlho treba pacientov liečiť a kedy je liečbu možné ukončiť. Dôležité je u jednotlivých pacientov vedieť, nakoľko závažná je forma migrény, na ktorú trpia, a koľko liekov už u nich zlyhalo, zhrnula prednášajúca.
Redakčne spracovali PhDr. Nikola Homolová Richtrová, Mgr. Kristýna Čillíková

